行业关注 - 谷胱甘肽结合几种不同抗癌化疗药物的生物学作用

许多抗癌药物的有效性取决于特定代谢物的产生,这些代谢物可能会改变它们的治疗或毒性特性。一种重要的生物转化途径是亲电子化合物与还原型谷胱甘肽(GSH)的结合,它可以是非酶促的或由谷胱甘肽依赖性酶催化的。谷胱甘肽通常与抗癌药物或其代谢物结合形成更具极性和水溶性的谷胱甘肽 S-结合物,很容易排出体外。
近期有研究团队认为谷胱甘肽介导的抗癌药物偶联的知识对于改善癌症治疗和预防癌症的耐药性是值得注意的。

谷胱甘肽是在所有动物组织、植物、真菌和一些微生物中发现的主要细胞内含硫醇三肽。在生理条件下,它主要以还原形式(GSH)存在于细胞质中,这也是生物活性形式。人体细胞中的 GSH 浓度通常在 0.1 到 10 mmol/L 之间,最集中在肝脏(高达 10 mmol/L)、脾脏、肾脏、晶状体、红细胞和白细胞,其中其消耗或改变与各种疾病有关,包括癌症、心血管疾病、炎症、免疫、代谢和神经退行性疾病。

GSH 在生物学上的重要作用与蛋白质的 -SH 部分再生的可能性有关,它抵消了氧化反应的影响,使细胞蛋白质失活。该化合物还参与将核糖核苷酸还原为脱氧核糖核苷酸,它对 DNA 生物合成和相关的增殖过程有直接影响。此外,它介导蛋白质的合成和氨基酸的转运。谷胱甘肽作为半胱氨酸的储存器和转运体、钙离子稳态的调节剂、许多细胞质酶的多功能辅助因子,它是线粒体机制与细胞死亡的联系。
除了上述功能外,GSH 还是系统的重要组成部分,通过 GSH S-缀合物的形成,对亲电子异生物质和代谢产生的自由基,即活性氧 (ROS) 进行解毒。因此,它在保护细胞免受各种外源性和内源性潜在有害化合物的侵害方面发挥着核心作用。因此,解毒途径的有效性取决于 GSH 的细胞内浓度、具有适当特异性的 GST 的存在或细胞快速再合成 GSH 的能力。
GSH 与亲电子化合物与 GSH S-结合物的结合反应主要发生在肝脏中,肝脏输出 GSH 并具有最高的 GST 活性。尽管通过与 GSH 结合,许多化合物的毒性低于原始母体异生素,但据报道,一些药物,包括具有抗癌活性的药物,在此反应后变得更具反应性。因此,GSH 偶联也可能在药物生物活化过程中发挥重要作用。

GSH 与广谱亲电试剂的亲核共轭和将相应的 GSH S 结合物从细胞中转运出来已被证明可以作为包括抗癌药物在内的外源性物质解毒系统发挥作用。该系统的主要成分包括 GSH、GSH 相关酶(主要是 GST)和 GSH S-共轭输出泵(GS-X 泵)。
系统反应的最终产物通常比母体化合物无毒、极性更强、更易溶于水,并且很容易通过胆汁或尿液排出体外。
虽然所呈现的巯基酸途径和巯基酸衍生物的运输可能因不同的化合物和物种而异,但 GSH 结合代表了通过解毒机制的细胞保护过程。
人们普遍认为,异生物质的 GSH 结合和硫醚转化为巯基酸是生物体抵御潜在有害化合物的生化防御。通常,由于解毒过程,许多物质会完全或部分失去其毒性。

GSH 结合在药物解毒中的重要性取决于它代谢为反应性中间体的程度。该反应可以是非酶(即化学)或酶催化的,其中 GST 发挥最大作用。
当产生软而强的亲电子试剂时,第一个被认为特别有效。反过来,软但弱的亲电试剂(或硬亲电试剂)的结合需要酶促干预以产生有效的 GSH 结合。
为了处理各种各样的潜在底物,存在多种 GST。在人体中,肝细胞溶质 GST 活性水平最高,其次是肾、肺和肠。有许多报告表明,结构不同的抗癌药物通过 GST 催化的过程形成 GSH S-结合物,然后降解并从体内去除。
一方面,与 GSH 相关的解毒途径降低了药物反应性并防止了可能由亲电子代谢物或 ROS 引起的对细胞大分子的进一步损害。在许多癌症中,相对于周围的健康组织,增强的非酶促 GSH 结合或编码特定 GST 的基因的过度表达被发现有助于增加抗癌药物的解毒作用。
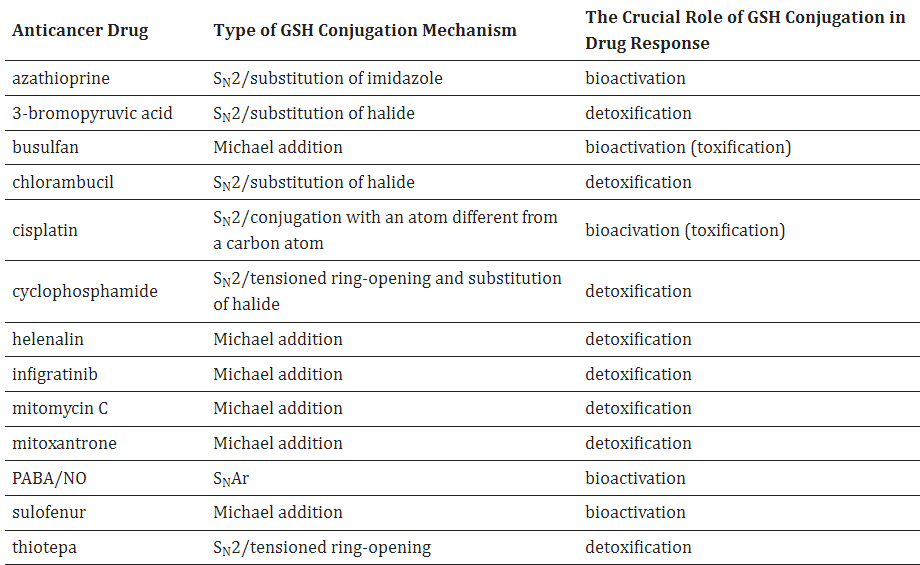
▲抗癌药物与 GSH 偶联的机制和作用
通过 GSH 结合代谢的含迈克尔受体的抗癌疗法的更多例子是阿法替尼、依鲁替尼和来那替尼。它们都是各种酪氨酸激酶的抑制剂,并使用它们自己的迈克尔受体部分与目标蛋白质的游离半胱氨酸残基不可逆地结合。
近年来,迈克尔受体对调节蛋白的这种靶向共价修饰被认为是一种有前途的药物发现方法。可以预期,GSH 在这些亲电子药物的清除中起着不可或缺的作用。
*特别说明 - 本文仅作资讯科普用途,不能代替医生的治疗诊断和建议,不应被视为对所涉医疗产品的推荐或功效证明。涉及疾病诊断、治疗、康复相关的,请务必前往专业医疗机构就诊,寻求专业意见。








